介绍非常关注的关注在Calix [4]的各种官能化上,在酚醛原子(下轮辋)和苯环(上边缘)基于构象分析的基础上进行研究。[1,2]摘要制备了许多杯[4]芳烃下缘4个羟基的衍生物,研究了它们在金属和有机阳离子的结合和转运方面的功能和行为。(3 - 5) 另一方面,膦酸盐、膦酸盐和膦氧化物衍生物被认为是有用的金属离子[6]的萃取剂和/或在有机合成反应中作为过渡金属催化剂的有效配体。[7]因此,开发新的Calix [4]阶段具有直接引入苯环的下边缘的那些磷基团是非常有价值的并且有用的是非常有价值的,这可能预期预期的前所未有的特异性功能和包括金属的运输和提取剂的特定功能和行为。有机阳离子,有机反应中的催化。 然而,只有合成报道杯[4]芳烃具有在低甲氧基组rim和两个diphenylphosphine氧化物,四膦酸酯[8],[9]或四个三苯基膦组[10]的直接取代的苯环上边缘,没有研究构象分析,功能和行为。众所周知,CALIX [4]的功能和行为在很大程度上受到特征构象(锥形,部分锥形,1,2-交替或1,3-交替)的影响,并且低轮辋的取代基,并且碱的构象稳定性在低轮辋处具有四个甲氧基的稳定性通常相对太低而表征。一些研究还已经在Calix的化学物质上进行了在上边缘具有四个膦酸盐或膦基团的阶段,其具有一些功能取代基,因为这些基团和苯环之间的间隔物,尽管Calix的化学[4]轴承四个羧酸盐[15,16]和磺酸盐(磺酸盐)[16,17]均为众所周知。 在该研究中,我们希望在下轮辋处的上边缘和四个烷基醚基团的四个膦酸盐或膦酰氧化物基团上报告各种新型胶囊[4]芳烃衍生物6-8的合成。此外,对这些化合物的构象分析和提取行为的研究表明,特定胶酶[4]芳烃(6C-CONE18)与四个二苯基氧基氧化物基团和用于提取FECL的基金组3.。 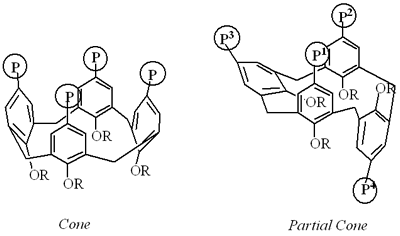
图1。锥形和部分锥形结构。 实验Arbuzov反应的典型步骤四溴杯[4]芳烃衍生物1-4与亚磷酸或膦酸酯的Arbuzov反应的典型程序 在180℃,二溴化镍(1 mmol)存在下,在苯腈(8 ml)中搅拌四溴杯[4]芳烃四烷基醚1-4 [16](1 mmol)。加入苄腈(2mL)三烷基亚磷酸盐或乙基二苯基膦酸乙酯(20mmol)溶液,将整体搅拌30分钟。在180˚C。溶液冷却到室温后,加入甲苯(100ml),用5%- nhh洗涤3.水溶液(100ml x 2)并干燥(MgSO4.).通过过滤除去干燥剂后,通过蒸馏蒸发溶剂。使用丙酮作为洗脱液,通过硅胶的闪光柱色谱法纯化残余物,得到所需产物,其在产率下几乎纯固体,如表1所示。所有产物为杯[4]芳烃衍生物,含有四个氧化二苯膦或四个二烷基膦酸酯5a, 6a-c, 7a-c和8a-c,通过光谱分析(IR, 1H-NMR, 13C-NMR, MASS)和元素分析进行表征,如下图所示。通过与真实样品光谱行为的比较,鉴定了杯[4]芳烃5b-c,其下缘有四个甲氧基,上缘有四个磷酸二丙酯或氧化二苯膦基。 5、11、17日23-Tetrakis (diethylphosphono) -25年,26日,27日28-tetramethoxycalix[4]芳烃[5]: 红外(整洁)1260 (P = O);1H-NMR(400MHz,CDCL3.)δ.: 7.78 (d、2 h, J = 13.2赫兹,Ph值),7.58 (d, 2 h, J = 13.2赫兹,Ph值),7.43 (d, 2 h, J = 12.7赫兹,Ph值),7.00 (d, 2 h, J = 13.2赫兹,Ph值),4.39 - -3.16 (m, 8 h,拱门2AR,OCH.2CH.3.,och.3.),3.61(BRS,3H,OCH3.),3.19(BRS,3H,OCH3.), 1.41-1.26(m, 15H, OCH2CH.3.),1.18(t,3h,j = 7.0hz,och2CH.3.), 1.03(brs, 6H, OCH2CH.3.);色谱仪(100 mhz, CDCl3.)δ.:161.1,161.0,160.9,160.8(D,4JPC = 3.7Hz),136.2,136.1,136.0,134.7(D,2JPC = 9.2Hz),133.9(D,3JPC = 14.7Hz),133.5,133.3,132.9(D,2JPC = 9.2Hz),132.5(D,2JPC = 11Hz),132.3(D,2JPC = 11.0Hz),122.7,122.6,122.1,122.0,120.8,61.9(S),61.8(S),60.7(s),60.0(s),58.5(S),53.8(S),36.4(S),31.7(S),30.8(S),30.6(S),30.5(S),29.2(S),16.3(s),16.2(s),15.9(s);MS(APCI,M +):1025.肛门:计算。对于C.48.H68O.16.P.4.:C,56.25;H,6.69。发现:C,56.45;H,6.59。 锥-5,11,17,23-四(二乙基膦)-25,26,27,28-Tetra-N-丙氧基[4] arene [6a]: M.P:150-152˚C;红外(KBr) 1260 (P = O);1H-NMR(400MHz,CDCL3.)δ.:7.28(d,8h,j = 7.3hz,pH), 4.49(d, 4H, J=13.2Hz, ArCH .2Ar), 4.00-3.85(m, 24H, OCH2CH.3.,och.2CH.2CH.3.),3.31(d,4h,j = 13.2hz,拱形2AR),1.97(Qt,8h,j = 7.0hz,och2CH.2CH.3.),1.21(t,24h,j = 7.0hz,och2CH.3.), 1.00(t, 12H, J=7.0Hz, OCH2CH2CH3);色谱仪(100 mhz, CDCl3)δ.:159.6(D,4JPC = 3.7Hz),134.6(D,3JPC = 14.7Hz),132.2(D,2JPC = 11Hz),122.2(D,1JPC = 191.2Hz),77.2(S),61.9(D,2JPC = 5.5Hz),30.9(S),23.1(s),16.2(d,3jpc = 5.5hz),10.1(s);31P-NMR(160MHz,CDCL3.)δ.: 13.7;女士(apci, M + + 1): 1138。肛门:计算的。对于C.56.H84O.16.P.4.: C, 59.15;H,7.45。发现:C,59.23;H,7.59。 锥-5,11,17,23-四(二异丙基膦)-25,26,27,28-Tetra-n-proxy-calix [4] arene [6b]: M.P:153-155˚C;红外(KBr) 1260 (P = O);1H-NMR(400MHz,CDCL3)δ.: 7.28 (d, 8 h, J = 13.3赫兹,Ph值),4.60 - -4.54 (m, 8 h, OCH (CH3.)2),4.59(d,4h,j = 12.7Hz,拱门2AR),3.94(t,8h,j = 7.0hz,och2CH.2CH.3.), 3.32(d, 4H, J=12.7Hz, ArCH .2Ar), 2.00-1.93(m, 8H, OCH2CH.2CH.3.),1.27(d,24h,j = 6.0hz,och(ch3.)2),1.00(t,12h,j = 7.5hz,och2CH.2CH.3.);色谱仪(100 mhz, CDCl3.)δ.:159.5(D,4JPC = 3.7Hz),134.4(D,3JPC = 16.5Hz),132.4 (d, 2 jpc = 9.2赫兹),122.8 (d, 1 jpc = 95.6赫兹),77.2 (s), 70.4 (d, 2 jpc = 2.6赫兹),31.2,24.0,23.8,23.8,23.1,10.2 (s);31P-NMR(160MHz,CDCL3.)δ.:11.5;女士(apci, M + + 1): 1250。肛门:计算的。对于C.64H85O.16.P.4.: C, 61.53;8.07 H,。发现:C, 61.45;H, 7。99. 23-Tetrakis Cone-5 11 17日(diphenyl-oxo-phosphino) -25年,26日,27日28-tetra-n-propoxycalix[4]芳烃(6 c): 国会议员:> 300˚C;红外(KBr) 1260 (P = O);1H-NMR(400MHz,CDCL3.)δ.: 7.42 - -7.21 (m, 48 h, Ph值),4.53 (d, 4 h, J = 13.2赫兹,拱门2AR),3.94(T,8H,J = 7.3Hz,OCH2CH.2CH.3.), 3.26 (d,4 h, J = 13.2赫兹,拱门2Ar), 1.98(qt, 8H, J=7.3Hz, OCH2CH.2CH.3.), 0.99(t, 12H, J=7.3Hz, OCH2CH.2CH.3.);色谱仪(100 mhz, CDCl3.)δ.:159.2,134.8(D,3JPC = 12.9Hz),132.7(D,1JPC = 103.0Hz),132.7(D,2JPC = 9.2Hz),131.7(D,JPC = 9.2Hz),128.5(D,JPC = 12.9Hz),125.6(D,1JPC = 106.6Hz),77.1(S),31.2(S),23.1(S),10.1;31P-NMR(160MHz,CDCL3.)δ.:22.3;MS(APCI,M ++ 1):1394。肛门:计算的。对于C.88H84O.8.P.4.: C, 75.85;6.08 H,。发现:C, 75.53;6.09 H,。 部分锥-5,11,17,23-四(二乙基膦酰基)-25,26,27,28-Tetra-n-proxy-calix [4] arene [7a]: M.P:150-151˚C;红外(KBr) 1260 (P = O);1H-NMR(400MHz,CDCL3.)δ.:7.72(D,2H,J = 13.7Hz,pH),7.61(D,2H,J = 13.2Hz,pH),7.41(D,2H,J = 13.2Hz,pH),6.98(D,2H,J= 13.7Hz,pH),4.28-3.38(m,30h,拱形2AR,OCH.2CH.3.,och.2CH.2CH.3.),3.21(d,2h,j = 13.2赫兹,拱2Ar), 1.99-1.81(m, 8H, OCH2CH.2CH.3.),1.40(t,6h,j = 7.0hz,ch3),1.38(t,6h,j = 7.0hz,ch3),1.25(t,6h,j = 7.0hz,ch3),1.03(t,6h,J = 7.0Hz,CH3),0.95(T,3H,J = 7.0Hz,CH3),0.73(T,3H,J = 7.0Hz,CH3.);色谱仪(100 mhz, CDCl3.)δ.: 160.9 (s), 160.1 (s),159.4 (d, 4 jpc = 3.7 hz), 136.5 (d、3 jpc = 16.6赫兹),134.7 (d, 2 jpc = 11.0赫兹),133.9 (d、3 jpc = 16.5赫兹),133.6 (d, 2 jpc = 9.2赫兹),133.1 (d、3 jpc = 16.5赫兹),133.1 (d, 2 jpc = 11.0赫兹),132.9 (d, 2 jpc = 11.0赫兹),132.6 (d, 2 jpc = 11.0赫兹),121.8 (d、3 jpc = 16.6赫兹),122.7 (d, 1 jpc = 193.1赫兹),121.2 (d, 1 jpc = 194.8赫兹),121.0 (d, 1 jpc = 191.2赫兹),76.6,75.6,73.8,62.0 (d, 2 jpc = 5.5赫兹),61.8 (d, 2 jpc = 5.5赫兹),61.7 (d, 2 jpc = 5.5赫兹),61.6 (d, 2 jpc = 5.5赫兹),36.9,30.4,23.4,22.9,21.1,16.4,16.4,16.3,16.2,16.0,16.0,10.6,10.1,9.2 (s);31P-NMR(160MHz,CDCL3.)δ.: 19.0, 18.6, 18.4;女士(apci, M + + 1): 1138。肛门:计算的。对于C.56.H84O.16.P.4.: C, 59.15;H,7.45。发现:C,59.32;H,7.49。 局部锥-5,11,11,11,11,11,11-四(二异丙基膦)-25,26,27,28-Tetra-N-丙氧基碱[4]芳烃[7B]: M.P:125-128˚C;红外(KBr) 1260 (P = O);1H-NMR(400MHz,CDCL3.)δ.:7.69(D,2H,J = 13.7Hz,pH),7.59(D,2H,J = 13.2Hz,pH),7.41(D,2H,J = 13.2Hz,pH),7.05(D,2H,J= 12.2Hz,pH),4.85-4.60(M,6H,OCH(CH3)2),4.37(M,2H,OCH(CH3.)2),4.14(d,2h,j = 13.2Hz,拱门3.AR),3.87-3.75(M,6H,Arch2AR,OCH.2CH.2CH.3.),3.63(t,2h,j = 8.0hz,och2CH.2CH.3.),3.53-3.41(m,4h,och2CH.2CH.3.),3.22(d,2h,j = 13.2Hz,拱形2Ar), 1.96-1.74(m, 6H, OCH2CH.2CH.3.), 1.40-1.20(m, 47H, OCH2CH.2CH.3.,och(ch3)2),1.01(t,6h,j = 7.3hz,och2CH.2CH.3.),0.92(t,3h,j = 7.3hz,och2CH.2CH.3.),0.75(t,6h,j = 6.0hz,och(ch3.)2);色谱仪(100 mhz, CDCl3.)δ.:160.6(D,4JPC = 3.7Hz),159.9(D,4JPC = 3.7Hz),159.3(D,4JPC = 3.7Hz),136.1(D,3JPC = 16.5Hz),134.6(D,2JPC = 9.2Hz),133.9(D,3JPC = 16.6Hz),133.3(D,2JPC = 11.0Hz),132。8(D,3JPC = 16.5Hz),132.8(D,2JPC = 9.2Hz),132.7(D,2JPC = 11.0Hz),132.6(D,3JPC = 16.6Hz),124.2(D,1JPC = 193.0Hz),122.7(D,1JPC = 194.8Hz),76.5(S),75.5(S),73.3(S),70.4(D,2JPC = 5.5Hz),70.3(D,2JPC = 5.5Hz),70.2(D,2JPC= 5.5Hz),70.0(D,2JPC = 5.5Hz),37.2(S),30.6(S),24.1(S),24.0(S),23.9(S),23.1(S),23.1(S),22.6(s),20.9(s),10.6(s),10.3(s),9.4;31P-NMR(160MHz,CDCL3.)δ.: 12.8、12.3、11.9;女士(apci, M + + 1): 1250。肛门:计算的。对于C.64H85O.16.P.4.: C, 61.53;8.07 H,。发现:C,61.65;H,8.25。 局部锥-5,11,17,23-四(二苯基 - 氧代磷氨基)-25,26,27,28-Tetra-N-丙氧基碱[4]芳烃[7C]: M.P:186-188˚C;红外(KBr) 1260 (P = O);1H-NMR(400MHz,CDCL3.)δ.: 7.77 - -7.72 (m, 4 h, Ph值),7.58 - -7.25 (m, 42小时,Ph值),7.15 (d, 2 h, J = 11.7赫兹,Ph值),4.17 (d, 2 h, J = 12.7赫兹,拱门2基于“增大化现实”技术),3.74(s,4h,拱形2Ar), 3.57(t, 4H, J=8.0Hz, OCH2CH.2CH.3.),3.46(t,4h,j = 8.0hz,och2CH.2CH.3.), 3.43(t, 4H, J=8.0Hz, OCH2CH.2CH.3.),3.16(d,2h,j = 12.7hz,Arch2ar),1.59-1.53(m,6h,och2ch2ch3),1.26-1.22(m,2h,och2CH.2CH.3.),0.90-0.80(m,9h,och2CH.2CH.3.),0.52(t,3h,j = 7.6hz,och2CH.2CH.3.);色谱仪(100 mhz, CDCl3.)δ.:160.9(D,4JPC = 3.7Hz),159.5(D,4JPC = 4.3Hz),136.5(D,3JPC = 12.9Hz),135.0(D,2JPC = 11Hz),134.0(D,JPC = 12.9Hz),133.6,133.5,133.4,133.3,133.2,133.1,133.1,132.9,132.9,132.8,132.4,132.4,132.1,132.0, 131.9, 131.8, 131.7, 131.6, 128.7, 128.6, 128.5, 128.4, 128.4, 128.4, 128.2, 126.9 (d, 1 jpc = 104.8赫兹),124.7 (d, 1 jpc = 108.4赫兹),124.4 (d, 1 jpc = 108.4赫兹),76.5,75.3,74.2,37.4,31.5,31.0,23.2,23.1,22.6,21.3,14.1,10.3,9.6 (s);31P-NMR(160MHz,CDCL2)δ.:23.2,22.6,22.3;MS(APCI,M ++ 1):1394。肛门:计算的。对于C.88H84O.8.P.4.: C, 75.85;6.08 H,。发现:C,76.06;H,5.98。 圆锥-5,11,17,23- tetrakis (diethylphosphono)-calix[4]arene Bis(crown ether) [8a]: M.P:231-232˚C;红外(KBr) 1260 (P = O);1H-NMR(400MHz,CDCL3.)δ.: 7.46 (d, 4 h, J = 11.2赫兹,Ph值),7.43 (d, 4 h, J = 11.2赫兹,Ph值),5.16 (d, 2 h, J = 12.2赫兹,拱门2Ar), 4.52(d, 2H, J=12.2Hz, ArCH2Ar), 4.35(d, 4H, J=10.7Hz, OCH2CH.2o),4.35(s,4h,哟2CH.2CH.3.), 4.24(s, 4H, J=10.7Hz,哟2CH.2o),4.01-3.86(M,20h,Och2CH.2o,och.2CH.3.), 3.37(d, 2H, J=12.2Hz, ArCH .2Ar), 3.32(d, 2H, J=12.2Hz, ArCH2Ar), 1.16-1.11(m, 24H, OCH2CH.3.);色谱仪(100 mhz, CDCl3.)δ.:158.7(D,4JPC = 3.7Hz),135.5(D,3JPC = 16.5Hz),135.3(D,3JPC = 16.5Hz),132.9(D,2JPC = 11.0Hz),132.0(D,2JPC = 11.0Hz),123.6(D,1JPC = 123.6Hz),76.3(S),73.9(S),62.0(S),30.5(S),29.7(S),16.1(D,3JPC = 3.7Hz);31P-NMR(160MHz,CDCL3.)δ.: 13.2;女士(apci, M +): 1109。肛门:计算的。对于C.52.H72O.18.P.4.: C, 56.32;6.54 H,。发现:C, 56.55;6.49 H,。 锥-5,11,11,11,23-四(二异丙基膦)-calix [4]芳烃双(冠醚)[8B]: M.P:185-186˚C;红外(KBr) 1260 (P = O);1H-NMR(400MHz,CDCL3.)δ.:7.43(D,4H,J = 13.2Hz,pH),7.42(D,4H,J = 13.2Hz,pH),5.15(D,2H,J = 12.7Hz,Arch2AR),4.58-4.50(M,10H,Arch2AR,OCH(CH3.)2), 4.35(d, 4H, J=11.2Hz, OCH2CH.2O),4.24(D,8h,J = 5.4Hz,OCH2CH.2o),3.87(M,4H,OCH2CH.2O), 3.36(d, 2H, J=12.7Hz, ArCH2AR),3.30(D,2H,J = 12.2Hz,Arch2AR),1.25(D,12H,J = 6.0Hz,OCH(CH3.)2),1.23(d,12h,j = 6.0hz,och(ch3.)2),1.09(d,12h,j = 6.0hz,och(ch3.)2), 1.05(d, 12H, J=6.0Hz, OCH(CH .3.)2);色谱仪(100 mhz, CDCl3.)δ.: 158.5 (d, 4 jpc = 3.7赫兹),135.2 (d、3 jpc = 16.6赫兹),135.0 (d、3 jpc = 16.6赫兹),132.8 (d, 2 jpc = 11 hz), 132.0 (d, 2 jpc = 11 hz), 125.1 (d, 1 jpc = 193 hz), 76.2 (s), 73.9 (s), 70.5 (d, 2 jpc = 5.5赫兹),30.7 (s), 29.8 (s), 23岁。9(s),23.8(d,3jpc = 3.7hz),23.7(d,3jpc = 3.7hz);31P-NMR(160MHz,CDCL3.)δ.:11.1;MS(APCI,M ++ 1):1221。肛门:计算的。对于C.60H84O.18.P.4.:C,59.01;H,7.26。发现:C,58.93;H,7.19。 锥-5,11,17,23-四(二苯基 - 氧代磷酸氨基)-calix [4]芳烯双(冠醚)[8c]: M.P:187-189˚C;红外(KBr) 1260 (P = O);1H-NMR(400MHz,CDCL3.)δ.:7.45-7.22(m,48h,pH),5.22(d,2h,j = 12.2hz,拱形2AR),4.55(D,2H,J = 12.2Hz,拱形2AR),4.35(D,4H,J = 10.8Hz,OCH2CH.2O), 4.24(d, 8H, J=4.9Hz, OCH2CH.2o),3.89-3.84(M,4H,OCH2CH.2o),3.27(d,2h,j = 12.2hz,拱形2AR),3.23(D,2H,J = 12.2Hz,拱形2基于“增大化现实”技术);色谱仪(100 mhz, CDCl3.)δ.:158.4(S),135.6(D,3JPC = 12.9Hz),135.4(D,3JPC = 12.9Hz),133.1(D,2JPC = 11Hz),132.3(D,1JPC = 117.7Hz),132.2(D,2JPC= 11Hz),131.8(S),131.6(S),131.5(S),128.5(D,JPC = 14.7Hz),126.9(D,1JPC = 104.8Hz),76.2(S),73.7(S),69.3(S),30.7(S),29.9(S);31P-NMR(160MHz,CDCL3.)δ.:23.1;MS(APCI,M ++ 1):1366。肛门:计算的。对于C.84H72O.10.P.4.:C,73.89;H,5.32。发现:C,74.13;H,5.69。 萃取性CALIX [4]芳香5,6,7和8种用于各种金属氯化物使用双层系统根据以下步骤测量用于各种金属氯化物的胶丸的可提取性:5-8的样品的氯仿溶液(20mL)(1.0 mmol DM.-3)和含有4N-盐酸和0.1mmol DM的水溶液(20mL)-3将金属氯化物在30℃下磁性搅拌20小时。取出上水溶液的等分试样,并通过电感耦合等离子体(ICP)发射光谱法分析。在没有任何样品的情况下进行类似的提取实验。萃取率是根据水溶液中金属氯的浓度来确定的,公式如下: 提取性(%)= [(a0.- a)/ a0.] x 100. 哪里A.0.和A分别为样品不存在(初始浓度)和存在(最终浓度)时金属氯的水溶液浓度。 复合物的隔离和性质在杯[4]芳烃6c和FeCl3之间Calix之间的复杂性[4] arenes 6c和fecl3.成功地从用于提取实验的双层氯仿溶液中分离出来。,并进行了光谱(UV和31P-NMR)、电化学(循环伏安法)和mp测量。 结果与讨论Tetrabroomocalix [4]芳烃衍生物1-4 {1(r = me-paco(=部分锥形)18),2(r = n-pr-cone),3(r = n-pr-paco),4(r= CH.2CH.2哟2CH.2- 根据所报道的方法的修饰方法制备.15,19,20 arbuzov TetraMocaLix [4]芳烃四丙基醚2(锥)和3(PACO)与三烷基亚磷酸酯(P(要么)3.)或二苯基膦酸乙酯(Ph2P(OEt))使用NiBr2作为在180℃的苄腈中的路易斯酸催化剂平滑地前进,得到相应的新胶片[4],得到6a-c(锥)和7a-c(paco),具有二烷基膦酸酯(po(或)2)或二苯基膦(pH值2PO)基团在每个苯环的对位,产率优良(51~97%),如表1所示。 表格1。通过arbuzov反应合成Tarphossono-(或磷酸氨磷)℃[4]芳烃衍生物。 
另一方面,新的Calix [4]芳香酮(锥形)和8C(锥形)以低产量从TetrabroomaLix [4]芳烃4(锥体)的反应,具有两个二亚乙二醇组,具有P(OET)3.和Ph值2P(OEt),而4 (cone)与P(O .)反应一世PR)3.以81%的产率为相应的产品8B(锥)。 测量胶睾丸的萃取性,如下进行5,6,7和8,如下进行。双层由1.0mmol DM的氯仿溶液组成-35-8和含有0.1 mmol dm的4n -盐酸水溶液-3在30˚C磁搅拌20 h。然后用电感耦合等离子体发射光谱法分析了上层水溶液中金属氯离子的浓度。 结果表明,具有4个二烷基膦酸酯基团的杯[4]芳烃5a,b, 6a,b, 7a,b和8a,b对FeCl等金属盐均无萃取性3.,Cocl.2, NiCl2,ZnCl.2和lacl.3.。另一方面,轴承的二苯基膦酰基氧化物基团5℃,6c,7c和8c仅展示了仅适用于FECL的高度选择性和优异的提取行为3.即使在含有相同浓度的各种金属氯化物(FeCl)的水溶液中3.,Cocl.2, NiCl2,ZnCl.2),如表3所示。 表2。P-NMR光谱胶质谱[4]芳烃衍生物。 
还值得注意的是,具有四个二苯基膦氧化物基团的6C,在5℃,6c,7c和8c之间的提取性最高,可能是因为下轮辋处的正丙基醚基团更加刚性,孔尺寸更多适用于[FECL4.-[如表3和4所示,阴离子。 表3。提取FeCl3.在与杯[4]芳烃衍生物5c-8c和7a,b。
|
1 |
5度 |
28. |
0.1 |
0. |
0. |
0. |
2 |
6摄氏度 |
80 |
1.0 |
0.2 |
0.7 |
0. |
3. |
7 c |
67 |
0.9 |
0. |
1.1 |
0. |
4. |
8C. |
46. |
1.0 |
0.8 |
0.7 |
0. |
5. |
7一个 |
0. |
0. |
0. |
0. |
0. |
6. |
7 b |
0. |
0. |
0. |
0. |
0. |
表4。提取FeCl3.用CALIX [4] ARENAS和TPPO的混合解决方案
|
1 |
5度 |
FECL.3. |
4 N. |
48. |
2 |
6摄氏度 |
FECL.3. |
4 N. |
92 |
3. |
7 c |
FECL.3. |
4 N. |
79 |
4. |
8C. |
FECL.3. |
4 N. |
69 |
5. |
7 b |
FECL.3. |
4 N. |
0. |
6. |
TPPO2 |
FECL.3. |
4 N. |
0. |
1提取条件:[有机相]:1mm-chcl3.,20ml [水相]:0.1mm的FECL3.,20ml,c [HCl]:4N,20H,30JC
2TPPO:三苯基膦氧化物 此外,三苯基氧化膦(TPPO)在提取条件下没有表现出任何可提取性(入口4),这表明杯[4]芳烃具有特定的结构特征。 有趣的是,随着双层体系水溶液pH值的增加,FeCl的萃取率(E%)逐渐增加3.当8n-hcl aq时,高达近100%。在该提取中使用,如图2所示。 ![Azojomo - 通过HCl浓度变化在线 - ZOO亚博网站下载 journal of Memoriginy - ECL3对Calix的浓度变化[4]芳烃6C](//www.washintong.com/work/3td2qTvKNU9g4UBLjUEg_files/image004.gif)
图2。提取FeCl3.通过HCl浓度变化对Calix [4]芳烃6c。 此外,用含有四个二苯基氧化膦基的杯[4]芳烃6c萃取从双层体系有机层中分离出的白色固体表现出特殊的电化学和光谱行为。因此,固体的熔点为80-81°(mp of 6c: >300 .°),小而特征性的吸收于λ.最大限度:紫外光谱为370纳米。杯[4]芳烃6c和固体在循环伏特中分别表现出-1.43 V和-1.92 V (vs. Ag/Ag+)的还原电位禁忌率和宽突出的峰值δ.= 41.2ppm在固体的31p-nmr光谱中,而6c显示单峰峰值δ.= 22.3 ppm。 从这些提取行为和特征性的这些实验结果,这种固体似乎由CALIX [4]芳烃6C和FECL之间的复合物组成。3.,如图3所示,其中四个二苯基膦氧化物基团的氧原子被质子化,以及FECL的分子4.阴离子包含在一个阳离子腔中,被四个6c的二苯基膦氧化物基团包围。锥形构象和下轮辋的四个OI-PR组可能负责为FECL的客体分子产生合适的腔体4.离子。 ![Azojomo - 亚洲材料杂志在线 - Calix之亚博网站下载间的复合体[4] arene 6c和fecl3](//www.washintong.com/work/3td2qTvKNU9g4UBLjUEg_files/image005.gif)
图3。Calix [4] arene 6c和fecl之间的复合物3. 结果表明,四溴杯[4]芳烃衍生物与保留原有构像的二苯膦酸乙酯进行Arbzov反应,合成了在6c、7c和8c四个苯环的p-位置上均含有二苯基氧化膦基的杯[4]芳烃衍生物。结果表明,它们对仅对FeCl具有较高的选择性和较高的离子对萃取能力3.,并且在轮辋处具有四个正丙基的6c表示最高的可提取性。 
图4。arbuzov反应。 承认这项研究得到了21世纪COE计划的支持,并获得了日本教育,科学,体育和文化部的优先领域(第13029038号)的科学研究。亚博老虎机网登录 参考和笔记1。C. D. Gutshe,“杯芳烃:超分子化学专论”,(1989)1,英国皇家化学学会,剑桥。 2。C. D.Gutsche,B. Dhawan,J.A.Levine,K。H. No和L. J.Bauer,Calix的9个构象异构体和Calix的酯类和酯的酯类竞争“Tetrahedron,39 3,(1983)409-426。 3.V.Böhmer,“杯芳烃,具有(几乎)无限可能性的宏观循环”,安新。化学。Int。艾德,心血管病。, 34(1995) 713-745。 4.S-K。Chanc和I. Cho,“新的金属阳离子选择性离子衍生自Calixarenes:它们的合成和离子结合特性”,J.Chem。SOC。Perkin Trans 1,(1986)211-214。 5。A. Ikeda和S. Shinkai,“1,3-替代杯的异常高离子心脏[4]竞技:∏-Donor Participation in Complexation of阳离子?”,四面体。, 33, 48,(1992) 7385-7388。 6.M. Takeshita和S. Shinkai,“Calixarenes官能化和识别能力的最新主题:”第三个宿主分子“,Bull.Chem。SOC。JPN。,68(1995)1088-1097。 7.K. Motojima, H. Hayakawa T. Kitagawa和Y. Yamamoto,“用有机试剂分离和分析”,shibunseki Koza 6,共立周刊,(1964)。 8.王志强,“金属催化交叉偶联反应的研究”,《化学学报》,第6期。,(1977)。 9.V. I. Malchenko,L. I. Atamas,V.V.Pirozhenko和L. N. Markovsky,Zh。obshch。khim。,62(1992)2623-.2625。 10。S. Ozegowski, B. Costisella and J. Gloede,“Selektive Einführung von phospylgruppen am ' Upper Rim ' von Calix[4]arenen Synthese und NMR-Untersuchungen”,磷、硫和硅,119(1996)207 -223。 11.F. Hamada,T.Fukugaki和K. Murai,“新的钙烯的过渡和碱金属阳离子的液 - 液提取:二苯基膦基Colix [4]芳烃甲醚”,J.Phenom。摩尔。公认。,10(1991)57-61。 12.此外,还对具有部分功能基团作为膦酸酯基团与苯环之间的间隔基团的杯[4]芳烃进行了化学(合成、构象分析和性质)研究。看到引用13 - 14日。 13。J.F.Malore,D. J.Marrs,M.A.Mckervey,P. O'Hagan,N. Thompson,A. Walker,F. Arnaud-Neu,O. Mauprivez,M.-J.Schwing-Weill,J.-f.Dozol,H. Rouquette和N.Imon,“Calix [N]醇氧化膦。新一系列阳离子受体,用于提取铕,钍,钚和亚美洲核废料处理“,J.Chem。 14。A. Arduini,V.Böhmer,L. delmau,J.-f.desreux,J.-f.Dozol,M.A.G.Cartera,B. Lambert,C ..Musigmann,A.Pochini,A. Shivanyuk和F.Ygoozzoli,凭借四个凭借股票顽固的Calixanes。碳酰上甲基膦酰胺或。氨基甲酰甲基磷苷在宽。rim“,化学。欧元。J.,6,12(2000)2135-2144。 15。M. Almi,A. Arduini,A. Casnati,A. Pochini和R. UNGARO,“钙屈剂的氯甲基化和新水可溶性宏环宿主的合成”,Tetrahedron,45,7(1989)2177-2182。 16.M.Rarsen和M.JøRgensen,“溴 - 取代的25,26,27,28-四丙氧基碱[4]芳烃的选择性卤素 - 锂交换反应”,J.Orene“。化学。,61(1996)6651-6655。 17.F. Hamada,S. G. Bott,G. W. Orr和A. W. Coleman,“Thiocalix [4]竞选。I.乙基碱[4]芳烃甲基醚的合成和结构及溴化甲基甲基醚的相关结构,J。Phenom。,9(1990)195-206。 18.S. Shinkai,K.Araki,M.Kubota,T.Arimura和T. Matsuda,“离子模板对水溶性钙屈剂的构象”,J.Org。化学。,56(1991)295-300。 19.锥形是锥形构象,PACO是部分锥形构象。 20。C. D.Gutsche和P.F.Pagoria,“Calixarenes。16.功能化钙克伦:直接替代途径“,J.Org。化学。,50(1985)5795-5802。 21。A. SOI,W.Bauer,H.Mauser,C. Moll,F. Hampel和A. Hirsch,“调查的动态性质为25,26,27,28-四烷氧基碱[4] areNes:对 - 取代基 - 和PACO适系体的溶剂依赖性特性和夹带锥形锥转化夹紧锥形锥转化的热力学参数的测定“,J.Chem。Soc。,perkin trans。2(1998)1471-1478。 详细联系方式 |