原子力显微镜(AFM)提供了在环境和液体环境中进行纳米到亚埃分辨率的表面结构的三维测量的能力。这些能力使生命科学在研究DNA、蛋白质和细胞方面取得了突破性进展。亚博老虎机网登录特别是,药物研究涉及到许多迅速受益于AFM的应用,这些应用既可以作为独立的技术,也可以作为目前可用的其他常见分析技术的有力补充。 本应用笔记考察了AFM如何提供在水合状态下高分辨率的基因传递载体的直接、单独调查的独特能力。 AFM历史与方法AFM是扫描探针显微镜(SPM)系列技术中最常用的形式。SPM的起源始于1982年苏黎世IBM公司的研究人员发明的扫描隧道显微镜(STM)。 STM能够分辨样品表面的原子结构,这一能力为发明者赢得了1986年的诺贝尔奖。然而,STM只能应用于导电或半导体样品。1986年,IBM公司和斯坦福大学合作开发了原子力显微镜,将这种显微镜扩展到绝缘体的研究。 AFM是通过在试样表面上扫描柔性悬臂梁末端的尖状物来实现的,同时保持一个小的恒力(见图1)。 
图1所示。集成单晶硅悬臂梁的扫描电镜图像(300X倍放大),末端半径为5nm ~ 10nm。 针尖的末端半径一般为5nm到10nm,但根据针尖类型的不同,半径也会有所不同。扫描运动是由一个压电管扫描仪进行的,它以光栅模式扫描样品的尖端(见图2)。 
图2。原子力显微镜的主要元件原理图,显示TappingMode操作的反馈回路。 TappingMode和联系方式AFM探针-样品相互作用通过将来自悬臂梁背面的激光反射到分裂光电二极管探测器上来监测。两种最常用的操作模式是接触模式AFM和TappingMode™AFM,它们可以在空气和液体环境中进行。 在接触模式AFM中,通过在每个横向(X,Y)数据点上垂直移动扫描仪(Z)以形成地形图像的反馈回路来保持恒定的悬臂偏转。 通过在扫描过程中保持恒定的偏转,在尖端和样品之间保持恒定的垂直力。尽管接触模式已被证明对广泛的应用是有用的,但它对相对软的样品不是那么有效。另一方面,TappingMode AFM由悬臂梁的谐振频率(通常为300kHz)振荡和以恒定的阻尼振幅扫描表面组成。反馈回路通过在扫描过程中垂直移动扫描仪来保持恒定的均方根(RMS)振幅,从而相应地保持恒定的作用力来形成地形图像。TappingMode的优势与接触模式相比,它通常在较低的垂直力下工作,并且消除了可能破坏一些样品的横向剪切力。因此,TappingMode已成为首选的技术成像软,易碎,粘着,和颗粒表面。 AFM在基因传递研究中的应用基因治疗作为治疗基因疾病的一种有效方法,已获得发展势头。 然而,这种治疗方式面临的主要障碍之一是将浓缩的遗传物质运送到预定的目标。有两种常见的DNA包装方法用于基因传递:病毒和非病毒。 虽然病毒介导的基因传递方式目前是最常见的,但由于激活患者的免疫反应,可能会产生问题,这可能会在使用前消除基因传递载体,并产生其他健康问题。为了避免这些并发症,脂质体或聚合物制造的非病毒载体被越来越多地用于封装DNA或其他药物相关材料。亚博网站下载AFM通过提供对DNA缩合过程的更深入的了解,成功地改进了这种基因载体的发展。图3显示了不同电荷关系形成的非病毒DNA缩合物。 
图3。一项非病毒基因传递载体的研究显示了四种不同的DNA浓缩状态:a)在NiCl上浓缩带负电荷2-treated云母,b)冷凝带负电荷的0.2 mm NiCl2, c)凝聚带正电荷,d)非凝聚。根据形成机制的不同,凝析油是紧密堆积或轻微散开的。1μm扫描。 在形成过程中的变量导致正电荷或负电荷的凝聚物,产生不同程度的DNA打包。 AFM提供了除了用于研究DNA缩合物的其他方法的明显优势。最大的优点之一是AFM能够在其水合状态下观察输送车辆的结构,因为它将出现在使用中。另外,用AFM在纳米尺度的分辨率下,研究人员可以很容易地成像DNA链,并观察它们如何与特定的聚合物或脂质体发生反应和凝聚。没有其他技术允许在高分辨率的水合状态下对单个车辆进行直接调查。例如,有各种不同的颗粒尺寸技术可以在非常多的凝析油上产生尺寸分布,但它们不能应用于单个凝析油。目前最常用的技术之一是电子显微镜(EM),它提供了查看单个冷凝物所需的高分辨率,但需要大量的样品制备时间,并要求样品在真空环境中干燥。因为干燥的基因载体可能会改变它们的结构,所以结果最多也就是用处不大。最坏的情况是,这些结果可能具有误导性,并导致无效的基因传递载体。
AFM一般应用于溶液中的基因载体。它们被注入液体细胞,附着在基质上,通常是云母。车辆被电荷固定在云母表面上。带正电荷的凝聚物自然地被吸引到带负电荷的云母表面,而带负电荷的凝聚物可以被吸引到带负电荷的云母上,要么在溶液中放置一个二价阳离子,要么用硅烷涂层云母形成ap -云母。然后通过TappingMode技术在溶液中进行AFM成像。虽然制备和执行简单,AFM因此能够提供非常高分辨率的单个DNA凝聚物。 基因提供y AFM的研究已经发表了许多基于afm的基因传递研究。Dunlap和同事研究了长度为5-7kb的超卷曲质粒DNA与阳离子脂质脂精胺(dioctylamidglycylspermine or DOGS)和阳离子聚合物聚乙烯亚胺(PEI)的缩合机制的变化。得到的冷凝物通过TappingMode成像在15mm NaCl溶液中。 对于狗和PEI,折叠的DNA环从中心核心辐射是明显的,这表明折叠的DNA环通过包装压缩。在图4中,可以清楚地看到DNA束和聚合物小球一起。该部分凝析液由具有多个凝析节点的长方形凝析液的圆化而形成环形结构。通过改变DOGS和PEI的浓度,考察了完全冷凝的条件。完整的PEI凝聚物的直径为20 ~ 40纳米,而完整的DOGS凝聚物的直径为50 ~ 70纳米。这表明PEI可能是一种比DOGS更有效的冷凝剂。大小和形态上的差异也可能影响它们作为转染剂的效率。 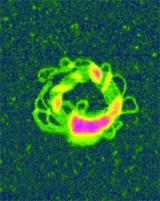
图4。用浓缩DNA和聚合物传递非病毒基因。一种阳离子聚合物聚乙烯亚胺(PEI)的橘红色小球,稳定了5kb质粒中黄绿色DNA环的圆形束。未固定分子在15mM盐溶液中TappingMode成像。 AFM也已被用于以原位图像的动态过程,以更好地了解与DNA缩合相关的形成机制。在实时在水溶液中观察到聚乙二醇化聚(酰胺胺)与DNA的缩合。聚合物-DNA缩合物的总正电荷用于将冷凝物静电保持给带负电的云母。然而,它没有如此刚性地保持,以防止凝结物在其形成期间的运动。 溶液中凝析油的成像显示了环状和棒状凝析油结构的存在。在图5中,可以观察到一个环形凝析液的形成,时间跨度为35分钟。从这些图像来看,环形结构似乎是通过连接棒状冷凝物的两端而形成的。 
图5。形成环状dna聚合物凝析液超过35分钟的时间跨度。比例尺= 200nm。 进一步的研究表明,在动态平衡状态下存在杆状和环形结构,冷凝物从棒状到环形,环形到杆状结构。在实时研究动态过程使得可以更好地了解凝结过程的动力学,这可能导致基因递送的显着改善。 结论AFM在研究纳米尺度的原位DNA结构方面取得了成功。这显然与开发更有效的基因传递载体有关。研究人员正在利用afm的许多优点——高分辨率、简化的样品制备、实时调查、无损成像和在液体中执行的能力——来研究DNA缩合机制和各种基因包装材料。亚博网站下载虽然上面讨论的例子只是用原子力显微镜进行的基因传递研究的一个样本,但它们表明了原子力显微镜对基因治疗的未来是多么重要。AFM的独特好处几乎肯定会在基因治疗的发展中发挥关键作用。 |