在制造药物疫苗中,必须测试中级,起始和最终产品的抗原水平。它们是针对降级或减毒细菌或病毒的量测量的。总蛋白质的分析测量是选择的技术,因为这些抗原通常包括蛋白质。
药典法规列出了几种合适的方法,其中包括许多UV/VIS分析(例如Lowry,Bradford,BCA分析)和两种总氮技术,即催化燃烧和Kjeldahl方法。
本文以催化燃烧技术为中心,该技术在Pharm中详细介绍。欧元。专着2.5.33,方法7 B:氧气中的氮化合物的高温热解至一氧化氮(NO),然后进行化学发光检测(CLD)。
该方法的描述几乎与EN 12260相吻合,概述了TN的测量b在环境水样品中,通过催化高温燃烧和对未分子的CLD检测。
这些分析仪可用于测定TNb在药品同样,这也是多N/C分析仪的设计。可以通过转换TN找到抗原的水平b进入总蛋白质。
由于蛋白质中氮的含量有所不同,通常建议将氮的总浓度转化为蛋白质的总浓度,通过与以下配方相关的6.25系数:C [总蛋白质] = C [总氮] x [总氮] x6.25。
亚博网站下载材料和方法
仪器
多N/C 2100S制药用于执行分析。表1列出了用于测量TOC含量的方法设置。
表格1。方法设置
| 范围 |
多N/C 2100S制药 |
| 测量参数 |
TNb |
| 消化 |
用铂催化剂在800°C下的高温消化 |
| 单一重复的数量 |
最小3,最大。4 |
| 注射前用样品冲洗 |
3次 |
| 注射量 |
75 µL |
| 稀释 |
1:1 |
样品和试剂
三个未知的客户样本,一个BSA控制标准和五个尿素TNb在客户站点准备的校准标准一式三份确定分析。在分析之前,将样品保存在冰箱中的4°C。
将液体样品在室温下进行调节后,使用微量移动物和快照盖覆盖并将其直接转移到2 mL样品小瓶中。使用自动进样器的微氧气注射器将75 µL样品等分试样转移到分析仪的炉中。
利用催化高温燃烧并得到铂催化剂的支撑,在纯氧气环境中,所有氮化合物均转化为一氧化氮(NO)。
然后使用化学发光检测器(CLD)定量测量NO。AutoSampler AS 60用注射器洗涤站和采样位置的自动磁搅拌协助测量序列。
校准
使用BSA蛋白标准溶液进行多点校准,用于将多N/C系统从5到60 mg/L校准总结合氮(TNb)。创建了BSA的200 mg TN/L库存溶液(Sigma Art.nr. A-7906,牛,白蛋白,纯度为98%,N-N-含量为15.60%),重量为128.2毫克,100 ml Ultra Ultra Pure Water。
通过计算6.25的N浓度的蛋白质浓度来确定分析样品的蛋白质浓度,这是文献中这种样品的标准转化因子。图1展示了校准曲线。

图1。TN - BSA校准曲线和特性范围5 - 60 mg/L N.的示例。
结果与讨论
每个样品至少分析了三次。
表2。液体样品。
| 样本ID |
平均值
TNb[µg/ml]±RSD [%]
(1.小瓶) |
平均值
TNb[µgm/l]±RSD [%]
(2.小瓶) |
平均值
TNb[µg/ml]±RSD [%]
(3.小瓶) |
| 10 ppm氮性病 |
10.77±0.14 |
10.80±0.51 |
10.74±0.19 |
| 20 ppm |
20.02±0.20 |
20.05±0.27 |
19.98±0.24 |
| 30 ppm氮性病 |
30.31±0.43 |
30.35±0.28 |
30.42±0.30 |
| 40 ppm氮病 |
40.59±0.27 |
40.62±0.42 |
40.65±0.35 |
| 50 ppm氮病 |
50.74±0.11 |
50.96±0.13 |
50.95±0.29 |
| 30 ppm BSA检查性病 |
30.80±0.54 |
30.89±0.45 |
30.88±0.40 |
| 样品 |
17.22±0.34 |
17.20±0.52 |
17.18±0.44 |
| 样品b |
27.95±0.22 |
27.97±0.21 |
27.93±0.40 |
| 样品c |
48.27±0.34 |
48.25±0.17 |
48.05±0.09 |
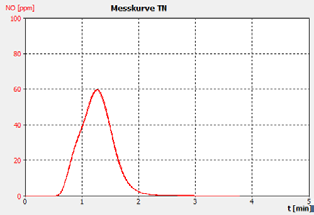
图2A。示例30 ppm bsa检查性病。
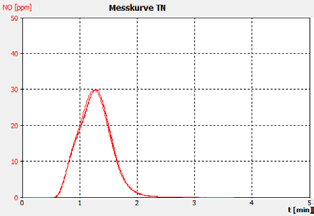
图2b。样品A。
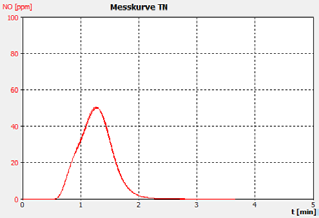
图2C。样品B。
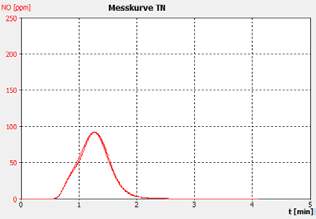
图2D。样品C。
结论
用低RSD和非常高的可重复性对所有样品进行定量。使用微液注射器使用直接注射系统的明显好处是,将样品从小瓶直接有效地转移到燃烧炉,而无需长管和阀。
这使得更好的小冲洗量最多为3倍75 µl。样品的消费可以保持在最低限度。五个重复需要少于1.4 ml的样品,需要三个冲洗循环和75 µL的代表注射体积。
配备有A的多N/C 2100S制药CLD检测器为了确定氮含量是根据Pharm.Eur中概述的催化高温消化技术进行这些样品的总蛋白质分析的理想系统。2.5.33方法7b。
分析仪的性能通过样品运行的峰形状证明,这表明重复之间没有显着的峰尾巴或移动,以及客户校准标准解决方案和检查标准(BSA)的恢复。

此信息已从Analytik Jena US提供的材料中采购,审查和改编。亚博网站下载
有关此消息来源的更多信息,请访问Analytik Jena我们。